徐浩新:溶酶体膜生理
3月23日,北京大学IDG麦戈文脑科学研究所邀请浙江大学徐浩新教授,在金光楼邓祐才报告厅作了精彩的学术报告,标题为“溶酶体膜生理”。陈良怡教授主持报告会。本期学术笔记由该报告整理而成。
溶酶体作为细胞中的垃圾处理中心,在物质降解和回收利用中具有重要作用,错误折叠的蛋白,损坏的细胞器,入侵的细菌病毒等会被运输到溶酶体进行降解。该过程有助于清除细胞中的有害物质并提供细胞生长代谢所需的原料。此外,溶酶体在营养感知和信号转导中也具有重要作用。溶酶体发挥正常功能需要合适的大小,形状,数量,定位和活性。当溶酶体中的酸性水解酶发生突变或者物质转运发生异常,导致生物大分子物质贮留在溶酶体中,会引发溶酶体贮积症(LSD),目前已经发现70多种LSD相关的疾病 1。另外,神经退行性疾病阿尔兹海默症(AD)和帕金森(PD)的发生也被认为和溶酶体功能紊乱相关。因此,研究溶酶体的功能及其调控是十分重要的。
徐浩新教授课题组自主研发了全溶酶体膜片钳技术,对溶酶体上包括钙离子通道,氢离子通道,钠离子通道和钾离子通道等在内的一系列离子通道展开研究,发现了各离子通道的调控机理及其功能(图1)2。其中,溶酶体氢离子通道TMEM175对于维持溶酶体的酸性环境和正常的物质降解具有重要作用3,而溶酶体水通道Lyso-AQP在维持溶酶体渗透压中发挥重要功能。本报告徐教授重点介绍了溶酶体钙离子通道TRPML1的内源激活剂及其功能。

图1. 位于溶酶体上的离子通道
1. TRPML1可以被内源性激动剂PI(3,5)P2激活
磷酸肌醇是膜转运的重要调控因子,而磷酸肌醇PI(3,5)P2会定位于溶酶体上并调控溶酶体转运,并在溶酶体融合位点处有大量富集。然而,长久以来,研究者并不清楚PI(3,5)P2调控溶酶体的机理。徐教授团队利用vacuolin-1等小分子选择性的膨大溶酶体,并通过溶酶体膜片钳技术钳住溶酶体,发现只需要100 nM低剂量的 PI(3,5)P2便可快速引起溶酶体上钙离子通道TRPML1介导的膜电流发生(图2)4。溶酶体腔内钙离子浓度约是胞浆浓度的1000-5000倍,TRPML1通道的激活可以促进钙离子外排出溶酶体,并调控溶酶体功能。进一步,通过序列分析和pull-down实验,证明PI(3,5)P2可以结合在TRPML1的氨基端,后续通过结构解析也证实了这一发现。

图2. PI(3,5)P2激活TRPML1通道
2. TRPML1调控溶酶体分泌和生物生成
为了更好地研究TRPML1对溶酶体功能的调控,徐教授团队利用高通量筛选结合化学修饰的方法,找到了可以特异性激活或抑制TRPML1的化学小分子(激动剂:ML-SA;抑制剂:ML-SI)。TRPML1重要功能之一是促进溶酶体转运到细胞膜附近并促进溶酶体分泌,从而促进细胞膜的修复。通过LAMP1标记发现,当细胞中加入TRPML1激动剂时,溶酶体会显著转运到细胞膜附近,而TRPML1敲除虽然会引起溶酶体数量代偿性增加,但溶酶体转运受损(图3)5。

图3. TRPML1激活促进溶酶体分泌
在肌肉细胞中,通过TIRF成像实验发现化学损伤会诱导溶酶体分泌的发生,从而促进肌肉细胞的细胞膜修复(图4)6。

图4.TIRF成像下ML1和VAMP7-pHluorin双阳性囊泡与质膜融合
TRPML1通道另一重要功能是促进溶酶体的生物生成。当细胞中线粒体发生损伤时,会通过线粒体自噬机制(mitophagy)清除受损的线粒体。在这个过程中,细胞内氧化物ROS水平增高,激活TRPML1通道,通过钙离子依赖而非mTOR依赖途径促进TFEB易位到细胞核,增强溶酶体生成相关基因的表达,从而促进受损线粒体和氧化物的清除(图5)7。
徐教授强调,TRPML1激活导致的溶酶体内钙离子外流之所以能够调控不同的生物学功能,是因为下游存在不同的钙离子感应器。
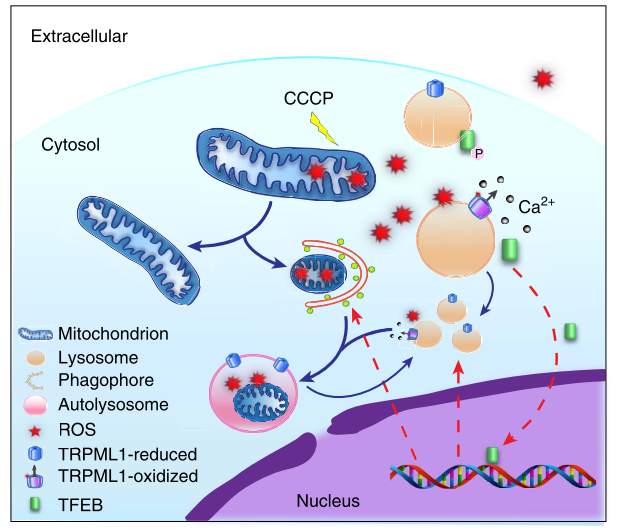
图5. TRPML1在ROS诱导的TFEB激活和自噬中的作用的工作模型
3. TRPML1可以作为药物研发的靶点
值得一提的是徐教授团队的后续研究发现,激活TRPML1是受损线粒体清除的充分条件,并且在“衰老色素”脂褐素(lipofuscin)的清除中发挥重要作用,而雷帕霉素可以通过mTOR非依赖途径激活TRPML1-TFEB通路。因此,激活TRPML1可以增强溶酶体功能,并加速细胞中有害物质的清除。目前,在针对TRPML1靶点的药物开发方面也取得了一系列进展。TRPML1的小分子激动剂可以改善杜氏肌肉营养不良小鼠的症状8,而研发的可通过血脑屏障的小分子物质可以改善AD和PD。未来,期待在临床研究和治疗中取得重大进展。
撰文:邢诗嘉
审核:陈良怡
参考文献
1. Platt, F.M., Davidson, B.L., Neufeld, E.F., and Tifft, C.J. (2018). Lysosomal storage diseases. Nat. Rev. Prim. 4, 27–52. 10.1038/s41572-018-0025-4.
2. Xu, H., and Ren, D. (2015). Lysosomal physiology. Annu. Rev. Physiol. 77, 57–80. 10.1146/annurev-physiol-021014-071649.
3. Hu, M., Li, P., Wang, C., Feng, X., Geng, Q., Chen, W., Marthi, M., Zhang, W., Gao, C., Reid, W., et al. (2022). Parkinson’s disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell 185, 2292-2308.e20. 10.1016/j.cell.2022.05.021.
4. Dong, X.P., Shen, D., Wang, X., Dawson, T., Li, X., Zhang, Q., Cheng, X., Zhang, Y., Weisman, L.S., Delling, M., et al. (2010). PI(3,5)P2 controls membrane trafficking by direct activation of mucolipin Ca2+ release channels in the endolysosome. Nat. Commun. 1, 1–11. 10.1038/ncomms1037.
5. Samie, M., Wang, X., Zhang, X., Goschka, A., Li, X., Cheng, X., Gregg, E., Azar, M., Zhuo, Y., Garrity, A.G., et al. (2013). A TRP channel in the lysosome regulates large particle phagocytosis via focal exocytosis. Dev. Cell 26, 511–524. 10.1016/j.devcel.2013.08.003.
6. Cheng, X., Zhang, X., Gao, Q., Samie, M.A., Azar, M., Tsang, W.L., Dong, L., Sahoo, N., Li, X., Zhuo, Y., et al. (2014). The intracellular Ca2+ channel MCOLN1 is required for sarcolemma repair to prevent muscular dystrophy. Nat. Med. 20, 1187–1192. 10.1038/nm.3611.
7. Zhang, X., Cheng, X., Yu, L., Yang, J., Calvo, R., Patnaik, S., Hu, X., Gao, Q., Yang, M., Lawas, M., et al. (2016). MCOLN1 is a ROS sensor in lysosomes that regulates autophagy. Nat. Commun. 7. 10.1038/ncomms12109.
8. Yu, L., Zhang, X., Yang, Y., Li, D., Tang, K., Zhao, Z., He, W., Wang, C., Sahoo, N., Converso-Baran, K., et al. (2020). Small-molecule activation of lysosomal TRP channels ameliorates Duchenne muscular dystrophy in mouse models. Sci. Adv. 6. 10.1126/sciadv.aaz2736.